Paseu-se per la meua conta de flickr per a veure les imatges dels compostos inorganics.
El meu nom d'usuari és paula.llorens.
miércoles, 25 de noviembre de 2015
OXOSALS
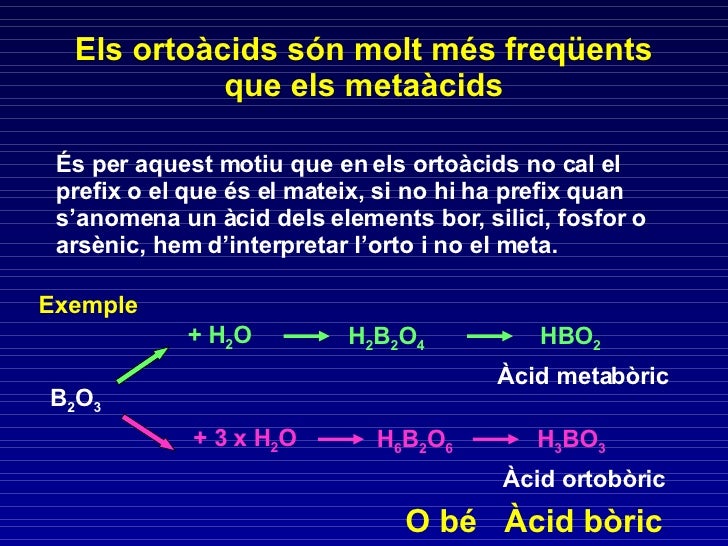
Son compostos ternaria o quaternaris que s'obtenen al sustituir els àtoms d'hidrogen dels àcids oxoàcids total o parcialment per àtoms de metalls.
Per a formular-les cla canviar el simbol H pel simbol del metall i la seua valència col.locarla com a subindex de la resta de l'àcid.
H N O3 àcid nítric
H2 S O4 àcid sulfúric
H Cl O àcid hipoclorós
K N O3 nitrat de potassi
Per a formular-les cla canviar el simbol H pel simbol del metall i la seua valència col.locarla com a subindex de la resta de l'àcid.
H N O3 àcid nítric
H2 S O4 àcid sulfúric
H Cl O àcid hipoclorós
K N O3 nitrat de potassi
OXOÀCIDS
TENEN UNA FORMULA : Hx E Oy






Les imatges son de :http://es.slideshare.net/iauquer/formulacioacids-oxoacids







Les imatges son de :http://es.slideshare.net/iauquer/formulacioacids-oxoacids
ÒXIDS
Un òxid és un compost químic que conté un o diversos àtoms d'oxigen, presentant l'oxigen un estat d'oxidació -2, i altres elements. Per exemple són òxids l'òxid nítric (NO), o el diòxid de nitrogen (NO2). Els òxids són molt comuns i variats en l'escorça terrestre. Són compostos binaris constituïts per oxigen i un element qualsevol, excepte el fluor. Els òxids es poden classificar en metàl·lics i no-metàl·lics.
- Per formular un òxid, primer s'escriu el símbol de l'element, després el de l'oxigen i, a continuació, s'intercanvien les valències. En els òxids, l'oxigen té valència 2.
- Per anomenar els òxids, es pot utilitzar la nomenclatura de Stock i la nomenclatura de IUPAC.
SALS BINÀRIES
- Sals binàries Es tracta d’un grup de compostos a on els àcids hidràcids perden l’hidrogen substituint-lo per un metall Per tant aquests compostos es faran amb un halogen F Cl Br I O bé amb un calcogen S Se Te València -1 València -2 + Metall
NOMS GENÈRICS PRINCIPALS SALS BINARIES: (-urs)
F=florur
P= fosfur
S= sulfur
Br=bromur
N= nitrur
C= carbur
Cl= clorur
Al2S3= en Stock sulfur d'alumini i en IUPAC trisulfur de dialumini
ClCu= en Stock clorur de coure(I) i en IUPAC clorur de coure
CuCL2= en Stock clorur de coure(II) i en IUPAC diclorur de coure
HIDRÒXIDS
Els hidròxids són grups (OH) amb valència -1 enllaçats a metalls. L’hidròxid dona nom a aquests compostos i per tant a l’hora de formular es posa al darrera. HIDRÒXIDS DE METALLS Exemple NaOH Hidròxid de sodi valència del sodi +1, valència de l’hidròxid -1 TOTAL = 0
Cu(OH)2= en Stock hidòxid de coure(II) i en IUPAC dihidròxid de coure.
Li OH= en Stock hidròxid de liti i en IUPAC hidròxid de liti.
Mg (OH)2= en Stock hidròxid de magnesi(II) i en IUPAC dihidròxid de magnesi.
Cu(OH)2= en Stock hidòxid de coure(II) i en IUPAC dihidròxid de coure.
Li OH= en Stock hidròxid de liti i en IUPAC hidròxid de liti.
Mg (OH)2= en Stock hidròxid de magnesi(II) i en IUPAC dihidròxid de magnesi.
HIDRURS
Són compostos binaris formats per àtoms d' hidrogen i qualsevol altre element.
- L'hidrogen té estat d'oxidació +1
- El no metall té l'estat d'oxidació negatiu.
- S'anomenen hidràcids, compostos que tenen caràcter àcid.
- Formulació: HIDROGEN + NO METALL. L'hidrogen s'escriu a l'esquerra, abans del símbol del no metall: HF, HCl, HBr, HI, H2S, H2Se, H2Te.
- Nomenclatura: nom no metall -ur d'hidrogen.
AlH3 en Stock= hidrur d'alumini i en Iupac= trihidrur d'alumini
BeH2 en Stock= hidrur de Beril.li i en Iupac=dihidrur de beril.li
martes, 24 de noviembre de 2015
LES VALÈNCIES
El: liti, sodi, potassi, rubidi, cesi i franci tenen 1 valència.
El: beril.li, magnesi, calci, estroci, bari i radi tenen 2 valències.
El: crom té2,3,6 valències.
El: manganés té 2,3,4.6.7 valències.
El: ferro té 2,3 valències.
El: cobalt té 2,3 valències.
El: niquel té 2,3 valències.
El: coure té 1,2 valències,
El: zinc té 2 valències.
El: pal.ladi té 2,4 valències.
El: platí té 2,4 valències.
El: cadmi té 2 valències.
El: mercuri té 2 valències.
El: or té 1,3 valències:
La plata té 1,3 valències.
El: bor i alumini tenen 3 valències.
El: carboni i silici tenen 2,4 valències.
El: nitrogen, fòsfor, arsènic, antimoni, bismut tenen 1,3,5 valències.
El: oxigen, sofre, seleni, tel.luri, poloni tenen 2,4,6 valències.
El: fluor, clor, brom, iode, astat tenen 1,3,5,7 valències.
L 'ÀTOM
L' ÀTOM
NUCLI DE L'ÀTOM:
-Nombre atòmic (Z): el número de protons que té un àtom al nucli.
-Nombre màssic(A): el nombre de protons més el de neutrons que té un àtom al nucli.
A=Z+N
-Nombre de neutrons (N) Aquest número pot variar entre els àtoms d' un mateix element i aquestos àtoms s' anomenen isòtops.
La massa atómica no és el nombre màssic.
Quan un àtom està en estat neutre, el número de protons és igual al d' electrons.
ESCORÇA DE LÀTOM:
Quan un àtom no està neutre, estem parlant d'un ió. Els ions poden tenir càrrega positiva, i s'anomenen cations, al haver perdut electrons. O poden tindre càrrega negativa, i s'anomenen anions, al haver guanyat electrons.
Els electrons dintre de l'escorça s'organitzen en nivells d'energia. Aquestos nivells tenen subnivells i aquestos també és mesclen.
La distribució dels electrons dintre de l' escoça s'anomena la configuració electònica de l'atom:
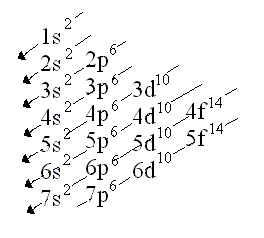
La imatge és de: http://www.quimitube.com/videos/configuracion-electronica-de-los-elementos-quimicos
EXERCISI-2
2-Realizta la configuració electrònica:
-Calci=Ca (z=20)= 1s2,2s2,2p6,3s2,3p6,4s2
-Pal.ladi=Pd (z=46)= 1s2,2s2,2p6,3s2,3p6,4s2,4p6,4d10,4d10
-Bismut=Bi (z=83)= 1s2,2s2,2p6,3s2,3p6,3d10,4s2,4p4,4d10,4f14,5s2,5p6,5d10,5f14
-Seleni=Se (z=34)= 1s2,2s2,2p6,3s2,3p6,3d10,4s2,4p6,4d8
-Ferro= Fe (z=26)= 1s2,2s2,2p6,3s2,3p6,3d10,4s2,4p6
-Mercuri=Hg (Z=80)= 1s2,2s2,2p6,3s2,3p6,3d10,4s2,4p6,4d10,4f14,5s2,5p6,5d10,5f
-Liti=Li (z=3)= 1s2,2s1
-Magnesi=Mg (z=12) = 1s2,2s2,2p6,3s2
lunes, 9 de noviembre de 2015
EXERCISI-1
1-Completa la següent taula:
NOM
|
SÍMBOL
|
Z
|
A
|
N
|
REPRESENTACIÓ
|
Calci
|
Ca
|
20
|
42
|
22
|
42
Ca
20
|
Bismut
|
Bi
|
83
|
172
|
89
|
122
Bi
83
|
Pal.ladi
|
Pd
|
46
|
98
|
52
|
98
Pd
46
|
Seleni
|
Se
|
34
|
72
|
38
|
38
Se
34
|
Ferro
|
Fe
|
26
|
56
|
30
|
56
Fe
26
|
Mercuri
|
Hg
|
80
|
166
|
86
|
166
Hg
80
|
Teluri
|
Te
|
52
|
108
|
56
|
108
Te
52
|
TAULA PERIÒDICA
LA TAULA PERIÒDICA
-Està ordenada pel nombre d' electrons.
-Z= nº d'electrons que té un element en estat neutre.
-Atom neutre - nº d'electrons = nº de protons.
Ejemple:
-H(z=1)-tos els àtoms d´H tenen 1 protó.
-Na(z=11)-tots els àtoms de Na tenen 11 protons.
Si el àtom està neutre- protons=electrons
+ -
Els neutrons tenen massa.
Es pot tindre àtoms dún element amb diferent nº de neutrons.
A-Z=N Z+N=A
Aquest és Dimitri Mendelétev;l'iventor de la taula periòdica:
 La imatge és de la viquipedia.
La imatge és de la viquipedia.
La següent imatge es de la taula periòdica: i es de quimicaipolmg.blogspot.com

LA MATÈRIA
LA MATÈRIA
La matèria es tot allò que te massa i volum.
-SUBSTÀNCIES: -Mescles formades per compostos com NH3, CO2 ,H2O que estan formats per elements.
-Elements com Li,Na,Sb,As,Fe.
-ELEMENTS: formats per atòms iguals - 1 atòm: -Nucli:-protons.
-neutrons.
-Escorça- electrons.
Suscribirse a:
Entradas (Atom)